Оксиды – это класс химических соединений, состоящих из элемента и кислорода. Они являются важными компонентами в различных сферах нашей жизни. Независимо от своей химической структуры, оксиды объединяются общими свойствами, такими как прочность, твердость и высокая температурная стабильность. Также многие оксиды обладают интересными электронными свойствами, которые можно использовать в различных технологиях.
В данной таблице представлены различные оксиды и их химические формулы. Каждый элемент имеет свое уникальное сочетание с кислородом, что приводит к разнообразию свойств и применений этих соединений. Оксиды могут быть кислотными, щелочными или амфотерными, в зависимости от реакции с водой или другими веществами. Кроме того, оксиды могут быть природными минералами или получаться искусственно в лабораторных условиях.
Примеры некоторых оксидов:
- Алюминий актиний Al2O3
- Углеродный диоксид CO2
- Железный оксид Fe2O3
- Кремниевый диоксид SiO2
- Сернистый диоксид SO2
Таблица оксидов может быть полезным инструментом для изучения химии, а также для применения в различных отраслях науки и промышленности. Знание оксидов и их свойств поможет понять многие процессы, происходящие в природе и человеческой деятельности. Оксиды – это неотъемлемая часть мира химии и природы в целом.
Таблица оксидов (часть):
| Оксид | Химическая формула | Описание |
|---|---|---|
| Оксид азота(II) | NO | Газ с резким запахом, образующийся при горении азота в кислороде. |
| Оксид углерода(II) | CO | Бесцветный газ, образующийся при неполном сгорании углеродсодержащих веществ. |
| Оксид фосфора(III) | P2O3 | Бесцветное вещество, образующееся при сгорании фосфора в кислороде. |
Оксиды металлов:
Оксиды металлов представляют собой химические соединения состоящие из металла и кислорода. В таблице ниже приведены некоторые из наиболее распространенных оксидов металлов:
| Металл | Оксид | Формула |
|---|---|---|
| Алюминий | Оксид алюминия | Al2O3 |
| Железо | Оксид железа(II) | FeO |
| Железо | Оксид железа(III) | Fe2O3 |
| Магний | Оксид магния | MgO |
| Цинк | Оксид цинка | ZnO |
Оксиды металлов имеют широкий спектр применения. Некоторые из них используются в производстве стекла, керамики, электроники и других отраслях промышленности. Кроме того, некоторые оксиды металлов обладают антибактериальными и антисептическими свойствами, и используются в медицине.
Оксиды неметаллов:
-
Оксиды – химические соединения, состоящие из неметалла и кислорода.
-
Оксиды неметаллов обладают различными физическими и химическими свойствами.
-
В таблице ниже представлены примеры некоторых основных оксидов неметаллов:
| Наименование оксида | Химическая формула |
|---|---|
| Оксид углерода (IV) | CO2 |
| Оксид азота (II) | NO |
| Оксид азота (IV) | NO2 |
| Оксид фосфора (V) | P2O5 |
| Оксид серы (VI) | SO3 |
Важно отметить, что оксиды неметаллов могут обладать как кислотными, так и основными свойствами.
Например, оксид азота (II) является газообразным соединением с кислотными свойствами, а оксид
кальция (оксид кальция (II)) имеет щелочные свойства и широко используется в строительстве.
Оксиды щелочных металлов:
Оксиды щелочных металлов представляют собой химические соединения, состоящие из атомов щелочных металлов и кислорода. В таблице ниже приведены некоторые из наиболее распространенных оксидов щелочных металлов:
| Щелочный металл | Название оксида | Химическая формула |
|---|---|---|
| Литий (Li) | Литиевый оксид | Li2O |
| Натрий (Na) | Натриевый оксид | Na2O |
| Калий (K) | Калиевый оксид | K2O |
| Рубидий (Rb) | Рубидиевый оксид | Rb2O |
| Цезий (Cs) | Цезиевый оксид | Cs2O |
Оксиды щелочных металлов обладают щелочными свойствами и растворяются в воде, образуя гидроксиды, которые являются основаниями. Они широко используются в различных отраслях промышленности и имеют большое значение в химии и материаловедении.
Оксиды переходных металлов:
Ниже приведена таблица оксидов переходных металлов:
| Металл | Оксид | Символ | Название |
|---|---|---|---|
| Железо | Fe | Оксид железа(II) | FeO |
| Fe | Оксид железа(III) | Fe2O3 | |
| Медь | Cu | Оксид меди(I) | Cu2O |
| Cu | Оксид меди(II) | CuO | |
| Марганец | Mn | Оксид марганца(II) | MnO |
| Mn | Оксид марганца(III) | Mn2O3 | |
| Хром | Cr | Оксид хрома(II) | CrO |
| Cr | Оксид хрома(III) | Cr2O3 |
Таблица оксидов переходных металлов позволяет увидеть соотношение металлов и их оксидов, а также изучить их химические символы и названия.
Оксиды благородных газов:
Оксиды благородных газов (часть):
- Оксид гелия (HeO2) – представляет собой нестабильное соединение, образующееся при взаимодействии гелия с кислородом. Известно только в экспериментальных условиях и является мощным окислителем.
- Оксид неона (NeO) – также является нестабильным соединением. Образуется при взаимодействии неона с кислородом. Используется в научных исследованиях.
- Оксид аргона (ArO) – образуется при взаимодействии аргона с кислородом. Является нестабильным и не имеет практического применения.
- Оксид криптона (KrO) – получается при взаимодействии криптона с кислородом. Это нестабильное соединение, которое также применяется в научных исследованиях.
- Оксид ксенона (XeO) – образуется при взаимодействии ксенона с кислородом. Является нестабильным соединением, используется в научных целях.
Оксиды полурадиоактивных элементов:
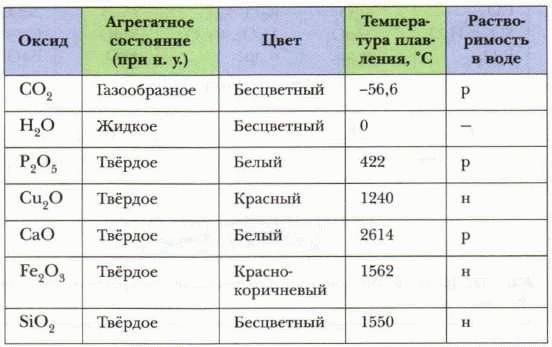
Ниже приведена таблица оксидов полурадиоактивных элементов в химических соединениях:
| Элемент | Оксид | Формула |
|---|---|---|
| Полоний | Оксид полония(IV) | PoO2 |
| Уран | Триоксид урана(VI) | UO3 |
| Плутоний | Оксид плутония(IV) | PuO2 |
| Америций | Оксид америция(III) | Am2O3 |
Таблица представляет собой часть периодической системы элементов и содержит информацию о некоторых оксидах полурадиоактивных элементов. Оксиды полурадиоактивных элементов имеют различные формулы в зависимости от химической природы элемента и его окислительного состояния.
