- Оксиды: свойства и классификация
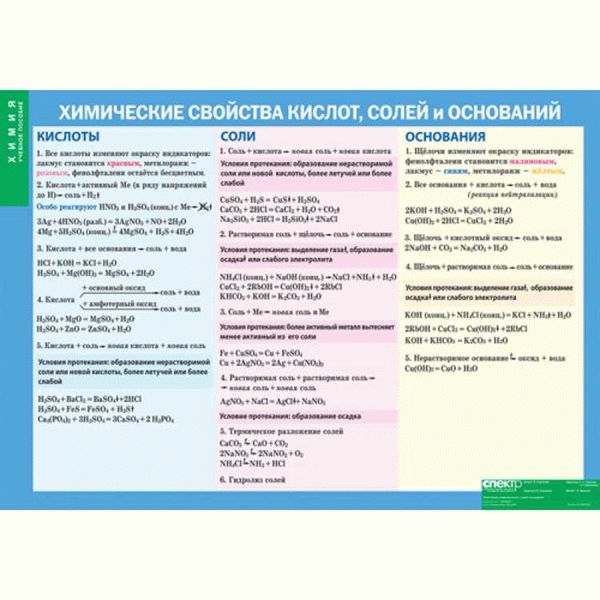
- Кислоты: химические соединения и их реакционная способность
- Основания: основные понятия и примеры в природе и промышленности
- Соли: состав и свойства соединений
- II Классификация оксидов
- Нейтральные оксиды: свойства и реакционная способность
- Кислотные и щелочные оксиды: особенности и их использование
Оксиды, кислоты, основания и соли – это основные классы химических соединений, которые играют важную роль в химии и науке в целом. Они имеют свои характеристики и свойства, которые определяются их составом и структурой.
Оксиды – это химические соединения, состоящие из химического элемента и кислорода. Они широко распространены в природе и являются основными компонентами земной коры. Оксиды могут быть двух типов: металлические и неметаллические. Металлические оксиды представляют собой соединения металла и кислорода, в то время как неметаллические оксиды состоят из неметалла и кислорода.
Кислоты – это соединения, которые обладают кислотными свойствами и способны образовывать ион водорода (H+). Кислоты могут быть органическими или неорганическими. Органические кислоты обычно содержат углерод и являются основными компонентами органических соединений, таких как уксусная кислота или лимонная кислота. Неорганические кислоты, с другой стороны, включают соляную кислоту, серную кислоту и многие другие.
Основания – это соединения, которые обладают щелочными свойствами и способны образовывать ион гидроксида (OH-). Они обычно состоят из металла и гидроксидной группы (OH). Основания можно классифицировать как сильные или слабые в зависимости от их способности образовывать ионы гидроксида. Примерами оснований являются натрий гидроксид (NaOH) и калий гидроксид (KOH).
Соли – это соединения, которые образуются в результате реакции оксидов, кислот или оснований с другими соединениями. Они обладают ионным строением и могут быть результатом нейтрализации, осаждения или других химических реакций. Соли имеют широкое применение в различных областях, включая промышленность, пищевую промышленность и медицину.
Оксиды: свойства и классификация
Оксиды – это химические соединения, состоящие из металла или не металла и кислорода. Они обладают широкими свойствами и широко распространены в природе.
Свойства оксидов могут значительно меняться в зависимости от их состава. Однако существуют общие особенности, характерные для большинства оксидов:
- Оксиды обычно являются твердыми веществами при комнатной температуре.
- Многие оксиды обладают высокой теплопроводностью.
- Оксиды обычно нерастворимы в воде, но могут растворяться в кислотах и основаниях.
- Они могут обладать разнообразными цветами и иметь различные запахи.
Оксиды могут быть классифицированы по различным категориям, включая:
- По типу элемента, они могут быть металлическими или не металлическими оксидами. Металлические оксиды образуются в результате реакции металла с кислородом, в то время как не металлические оксиды образуются в результате сочетания не металла с кислородом.
- По степени окисления элемента в оксиде, они могут быть низкими или высокими оксидами. Низкие оксиды содержат меньшую степень окисления элемента, в то время как высокие оксиды содержат более высокую степень окисления.
- По типу кислотности они могут быть кислотными или основными оксидами. Кислотные оксиды реагируют с водой, образуя кислоты, в то время как основные оксиды реагируют с водой, образуя основания.
Классификация оксидов является важным шагом в изучении и понимании их свойств и реакций. Она помогает определить их роль в химических процессах и применении в различных областях науки и технологий.
Кислоты: химические соединения и их реакционная способность
Кислоты – это важный класс химических соединений, обладающих способностью выделять водородные ионы (H+) в растворе. Они реагируют со многими веществами, проявляя характерную кислотность.
Классификация кислот происходит по различным признакам, включая степень окисления центрального атома, органическую или неорганическую природу, код Мерфи и др.
Неорганические кислоты образуются при соединении водорода с различными не металлами. Они могут быть двух- или многоосновными в зависимости от количества выделяющихся водородных ионов. Примеры неорганических кислот:
- Соляная кислота (HCl) – бесцветная жидкость с резким запахом, важное промышленное и лабораторное реагент. Используется в процессах химического синтеза и анализа.
- Азотная кислота (HNO3) – безцветная или слегка желтоватая жидкость, самая сильная неорганическая кислота. Широко использована в промышленности для производства удобрений, взрывчатых веществ и других химических соединений.
- Серная кислота (H2SO4) – безцветная или слегка желтоватая жидкость с выраженной кислотностью. Одна из наиболее распространенных химических веществ в промышленности. Используется в производстве удобрений, кислотных аккумуляторов, драгоценных металлов и др.
Органические кислоты содержат в молекуле группу -COOH. Эти кислоты являются слабыми и менее агрессивными по сравнению с неорганическими кислотами. Примеры органических кислот:
- Уксусная кислота (CH3COOH) – безцветная жидкость с характерным запахом, широко используется в пищевой и лакокрасочной промышленности.
- Лимонная кислота (C6H8O7) – белые кристаллы, пищевая добавка, используется для консервирования и приготовления пищи.
- Салициловая кислота (C7H6O3) – белые кристаллы, является прототипом аспирина и широко используется в фармацевтике и косметической промышленности.
Важно отметить, что кислоты могут проявлять различную реакционную способность, в зависимости от условий реакции и их химической структуры. Кислоты могут реагировать с основаниями, образуя соли и воду, с металлами – образуя металлические соли и выделяя водород, а также проявлять реакцию с оксидами, превращая их в соли и воду.
Реакционная способность кислот важна не только для определения их свойств, но и для различных промышленных процессов, синтеза лекарственных веществ, производства удобрений и многих других отраслей науки и производства.
Основания: основные понятия и примеры в природе и промышленности
Основания – это вещества, способные образовывать гидроксиды в растворе, а также принимать или отдавать электронные пары при реакциях с кислотами.
Классификация оснований:
- Основания, образованные металлами:
- Гидроксиды – соединения металлов с ионом OH–. Например, гидроксид натрия NaOH, гидроксид калия KOH.
- Основания, не образованные металлами:
- Аминолизы – органические соединения, содержащие атомы азота. Например, этиламин C2H5NH2, аммония гидроксид NH4OH.
- Гидроксиды неметаллов – соединения неметаллов с ионом OH–. Например, гидроксид аммония NH4OH.
Примеры оснований в природе:
- Гидроксид кальция Ca(OH)2 – содержится в известняке и является основным компонентом извести, используемого в строительной и других отраслях промышленности.
- Гидроксид магния Mg(OH)2 – известен как молочная известь и используется в медицине как слабительное.
Примеры оснований в промышленности:
- Натриевая гидроксид NaOH, также известная как щелочь, является одним из наиболее распространенных оснований в промышленности. Оно используется в производстве бумаги, мыла, стекла и других товаров.
- Калиевая гидроксид KOH – применяется в процессе сапонификации для производства жидкого мыла.
| Название | Химическая формула | Природное происхождение | Использование в промышленности |
|---|---|---|---|
| Гидроксид кальция | Ca(OH)2 | Известняк | Строительство, производство цемента |
| Гидроксид магния | Mg(OH)2 | Молочная известь | Медицина, промышленность |
| Натриевая гидроксид | NaOH | Природно не встречается | Производство бумаги, мыла, стекла |
| Калиевая гидроксид | KOH | Природно не встречается | Производство жидкого мыла |
Соли: состав и свойства соединений
Соли – это химические соединения, образованные в результате реакции нейтрализации кислот и оснований. Солями называют также их производные, полученные путем односторонней замены водородных атомов кислоты на металлы.
Соли имеют сложную структуру и состоят из двух частей: катиона и аниона. Катион – положительно заряженная частица, которая представляет металлический ион, а анион – отрицательно заряженная частица, представляющая атом или группу атомов неметалла.
Соли могут быть классифицированы по различным признакам, например, по ионной формуле или по химическому составу. Классификация солей по ионной формуле основана на идентификации ионов, из которых они состоят.
Соли могут обладать различными свойствами, в зависимости от вида катиона и аниона. Некоторые соли обладают характерным цветом, который определяется наличием вещества, отвечающего за окраску. Другие соли растворяются в воде и образуют растворы, которые могут быть кислотными, щелочными или нейтральными.
Соли широко используются в различных областях, например, в пищевой промышленности, медицине, сельском хозяйстве и технологии. Их свойства и состав делают их полезными в различных процессах и при исследованиях.
II Классификация оксидов
Оксиды – это химические соединения, состоящие из кислорода и других элементов. Они являются одними из основных классов неорганических соединений. Классификация оксидов осуществляется на основе различных признаков, их можно разделить на:
- Металлические оксиды – образуются при реакции металла с кислородом. Примерами таких оксидов являются оксид железа (Fe2O3) и оксид алюминия (Al2O3).
- Неметаллические оксиды – образуются при реакции неметалла с кислородом. Некоторые из них обладают кислотными свойствами, например диоксид серы (SO2) и оксид азота (NO2).
В свою очередь, неметаллические оксиды можно классифицировать на:
- Кислотные оксиды – образуют кислоты, соответствующие кислотным свойствам оксида. Например, диоксид серы (SO2) образует серную кислоту (H2SO4).
- Основные оксиды – реагируют с водой, образуя основания. Примером такого оксида является оксид кальция (CaO), который реагирует с водой, образуя гидроксид кальция (Ca(OH)2).
- Амфотерные оксиды – обладают как кислотными, так и основными свойствами. Например, оксид алюминия (Al2O3) образует и кислоты, и основания.
- Нейтральные оксиды – не образуют ни кислоты, ни основания. Они нейтральны по отношению к воде и химически инертны. Примером такого оксида является оксид углерода (CO).
Классификация оксидов помогает нам лучше понять их свойства и возможные реакции, а также использование этих соединений в различных областях, таких как химическая промышленность, металлургия и электроника.
Нейтральные оксиды: свойства и реакционная способность
Оксиды – это соединения химических элементов с кислородом. Классификация оксидов осуществляется по их реакционной способности и характеру взаимодействия с кислотами, основаниями и водой. Одним из типов оксидов являются нейтральные оксиды.
Нейтральные оксиды характеризуются тем, что они не обладают ни кислотными, ни основными свойствами. Они не реагируют с водой и не проявляют кислотные или основные свойства в сочетании с кислотами или основаниями.
Свойства нейтральных оксидов:
- Обладают выраженными окислительными способностями;
- Образуют с металлами или неметаллами соли, но не могут образовывать с ними кислоты;
- Могут выражать свою активность только в реакциях с веществами, способными давать основания, но они не проявляют самих свойств основания или кислоты.
Примеры нейтральных оксидов: оксиды металлов из II группы, например, оксид цинка (ZnO), оксид магния (MgO), оксид кальция (CaO) и др.
Реакционная способность нейтральных оксидов обусловлена их выраженной окислительной активностью. Они могут взаимодействовать с веществами, способными давать основания, образуя соли. Например, оксид цинка может реагировать с гидроксидом натрия (NaOH) и образовывать соль – гидроксид цинка (Zn(OH)₂).
Кислотные и щелочные оксиды: особенности и их использование
Оксиды – это химические соединения, состоящие из кислорода и других элементов. В зависимости от своих свойств, оксиды могут быть кислотными или щелочными.
Кислотные оксиды образуются при взаимодействии кислорода с неметаллами. Эти оксиды обладают кислотными свойствами и могут реагировать с щелочами или основаниями, образуя соли и воду. Примеры таких оксидов: диоксид серы (SO2), диоксид азота (NO2), оксид углерода (CO2).
Щелочные оксиды образуются при взаимодействии кислорода с металлами. Эти оксиды обладают щелочными свойствами и могут растворяться в воде, образуя гидроксиды металлов. Примеры таких оксидов: оксид натрия (Na2O), оксид калия (K2O), оксид кальция (CaO).
Классификация оксидов на кислотные и щелочные является основополагающей в химии. Кислотные оксиды играют важную роль в процессе образования кислотных растворов и взаимодействия с щелочами. Щелочные оксиды, в свою очередь, широко применяются в производстве стекла, керамики и других материалов, а также в процессе получения щелочей и гидроксидов металлов.
